AISTLEITNER E. & AISTLEITNER U., 1996. Die Tagfalter des Fürstentums Liechtenstein (Lepidoptera: Papilionoidea und Hesperioidea). Naturkundliche Forschung im Fürstentum Liechtenstein, Band 16, Vaduz, 162p. LIEN
Arnason A.N & Schwarz C.J., 1999. Using POPAN-5 to analyse banding data. Bird Study, 46 (suppl.) : 157-168. LIEN
BAILLET Y. 2011. Suivi et bilan des Lépidoptères protégés (Maculinea teleius & Coenonympha oedippus) et complément d’inventaire des lépidoptères diurnes sur l’ENS du Marais de Montfort (Crolles – Isère). Rapport d’étude de Flavia A.D.E., Trept, 71 p. LIEN
Bellour 2013. Etude conservatoire du Fadet des Laîches (Coenonympha oedippus, Fabricius 1767) au sein de l’ENS du Marais de Montfort-36 pages + annexes.
BENSETTITI F. & GAUDILLAT V. (coord.), 2002. « Cahiers d’habitats » Natura 2000. Connaissance et gestion des habitats et des espèces d’intérêt communautaire. Tome 7 – Espèces animales. MEDD/MAAPAR/MNHN. Éd. La Documentation française, Paris : pp.271-274. LIEN
Bertolini A., Leclère M., Le Moal T., Robinet C. et Soulet D., 2013. Programme régional « Amélioration des connaissances et conservation de 5 espèces de papillons diurnes menacés des zones humides en Aquitaine ». Bilan de la phase initiale du programme (octobre 2010 – mars 2013). Conservatoire d’Espaces Naturels d’Aquitaine (CEN Aquitaine), 480 pages + annexes.
BINK, F.A. 1992. Ecologische Atlas van de Dagvlinders van Noordwest-Europa. – Schuyt & Co, Haarlem.
Bischof A., 1968. Coenonympha oedippus Fabricius, eine kleine Chorographie (Lepidoptera, Satyridae). Mitt Ent Ges Basel 18: 41–63.
BOCQUET A., 2015. Etude de la niche écologique du Fadet des Laîches (Coenonympha oedippus, FABRICIUS, 1787) et des facteurs contraignant sa répartition à l’échelle européenne. Rapport stage Master 1, LECA, 17p.
BONELLI S., CANTERINO S. & BALLETTO E., 2010. Ecology of Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) in Italy. Oedippus 26 : 25-30. LIEN
BOURN N.A.D. & WARREN M.S., 1997. Species Action Plan Large Heath (Coenonympha tullia). Unpublished working document produced by Butterfly Conservation, 25p. LIEN
Brakefield P.M., 1982. Ecological studies on the butterfly Maniola jurtina in Britain. II. Population dynamics: the present position. Journal of Animal Ecology 51: 721-738. LIEN
BRAÜ M., DOLEK M. & STETTMER C., 2010. Habitat requirements, larval development and food preferences of the German population of the False Ringlet Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) – Research on the ecological needs to develop management tools. Oedippus 26 : 41-51. LIEN
BRAÜ M., VOLKL R. & STETTMER C., 2016. Entwicklung von Managementstrategien für die FFH-Tagfalterart Moor-Wiesenvögelchen (Coenonympha oedippus) in Bayern – Teil I: Forschungsresultate zur Ökologie der Art. ANLIEGEN NATUR 38(1) : 59–66. LIEN
Bubova T., Vrabec V., Kulma M., Nowicki P., 2015. Land management impacts on European butterflies of conservation concern : a review. Journal of Insect Conservation 19 : 805-821. LIEN
CATZH-CEN Aquitaine, 2012a. Evaluation des mesures de gestion des zones humides de Sud de Cap de Manes, Orthez. 6p.
CATZH-CEN Aquitaine, 2012. Evaluation des mesures de gestion des zones humides de Lacampagne, Orthez. 4-6.
CELIK T., 2003: Populacijska struktura, migracije in ogroženost vrste Coenonympha oedippus Fabricius, 1787 (Lepidoptera: Satyridae) v fragmentirani krajini. Doktorska disertacija Population structure, migration and conservation of Coenonympha oedippus Fabricius, 1787 (Lepidoptera: Satyridae) in a fragmented landscape, dissertation thesis). Univerza v Ljubljani, Biotehniška fakulteta, Oddelek za biologijo, Ljubljana, 100 s.
CELIK T., 2004 – Population dynamics of endangered species Coenonympha oedippus Fabricius, 1787 (Lepidoptera: Satyridae) on the Ljubljansko Barje (Slovenia). Acta Entomologica Slovenica 12 (1) : 99-114. LIEN
CELIK T., VRES B. & SELISKAR A., 2009a. Determinants oh within-patch microdistribution and movements of endangered butterfly Coenonympha oedippus (Fabricius, 1787) (Nymphalidae : Satyrinae). Hacquetia, 8/2, 115-128. LIEN
CELIK T., VRES B. & SELISKAR A., 2009b. Ocena stanja populacij in habitatov ter predlog monitoringa za ogrožene vrste barjanski okarcek (Coenonympha oedippus), mocvirski tulipan (Fritillaria meleagris) in Loeselova grezovka (Liparis loeselii) na Ljubljanskem barju. Koncno porocilo. 67p. LIEN
CELIK T. & VEROVNIK R., 2010. Distribution, habitat preferences and population ecology of the False Ringlet Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) in Slovenia. Oedippus 26 : 7-15. LIEN
CELIK T., BRAÜ M., BONELLI S., CERRATO C., VRES B., BALLETTO E., STETTMER C. & DOLEK M., 2014. Winter-green host-plants, litter quantity and vegetation structure are key determinants of habitat quality for Coenonympha oedippus in Europe. Journal of Insect Conservation, 19 : 359-375. LIEN
CREN Aquitaine, 2002. Conservation de deux espèces de lépidoptères menacés : M. teleius et C. oedippus (24). Chapitre 2 : Méthodologie du suivi des deux lépidoptères. 9p.
CREN Aquitaine, 2004. Faisabilité d’une gestion Conservatoire des micro-zones humides de la Double et du Landais.
CREN Aquitaine, LE MOAL T. & ROYAUD A., 2007. Tourbière de l’Estanque et de l’Estiraux – Bilan d’activité 2006. 332 p. + annexes.
CLAUDEL L., 2003. Ecologie et gestion conservatoire d’un papillon menacé Coenonympha oedippus à la réserve naturelle de l’Etang du Cousseau. 31p. + annexes.
Cooch E.G. & White G.W., 2002. Program MARK : analysis of data from marked individuals. LIEN
DEJEAN, S. 2014 – Plan de gestion de la lande de Ger – Camp militaire de Ger. Rapport d’étude, Conservatoire d’espaces naturels de Midi-Pyrénées. 61 p. + annexes.
Demerges D. & Luquet G., 2007. Coenonympha oedippus, le Fadet des laîches – Ministère de l’écologie, du développement et de l’aménagement durables : Papillons de l’annexe IV de la Directive 92/43/CEE dite «Directive Habitats» – Biotope, 4p.
Deschamps J., 2017. Potentialité d’accueil des centrales photovoltaïques pour le Fadet des laîches Coenonympha oedippus dans le massif des Landes de Gascogne. Rapport de stage de Master 2 Mention Biodiversité, Écologie et Évolution, parcours « Biodiversité et suivis environnementaux ». Université de Bordeaux. 42 p.
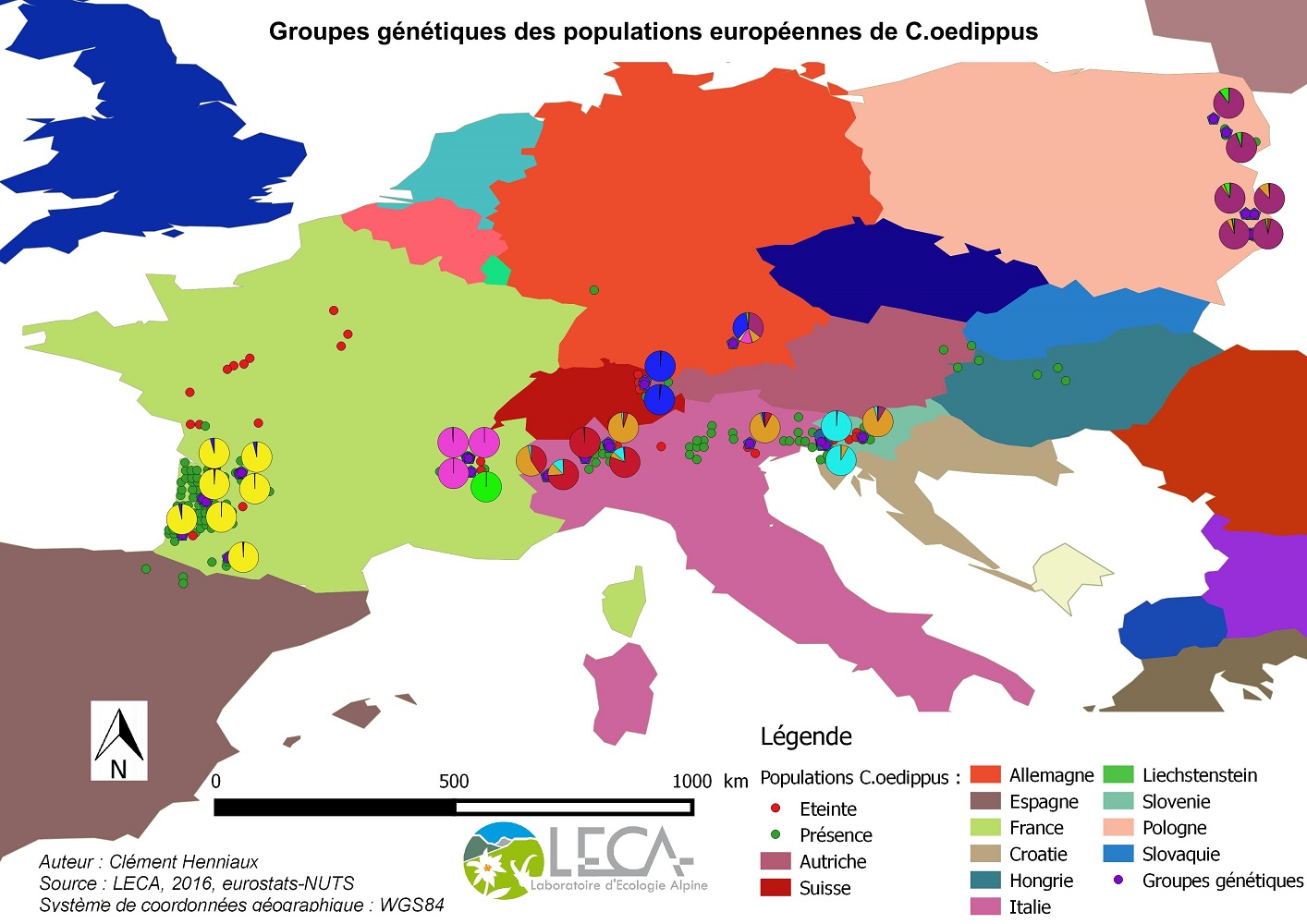
Desprès L., Henniaux C., Rioux D., Capblancq T., Zupan S., Celik T., Sielezniew M., Bonato L., Ficetola G. F., 2018. Inferring the biogeography and demographic history of an endangered butterfly in Europe from multilocus markers. Biological Journal of the Linnean Society, 2018, XX, 1–19.
DESPRES L., JOHNSON M., XAVIER J. & HENNIAUX C., 2016. Écologie et démographie du Fadet des Laîches, Coenonympha oedippus, au marais de Montfort et implications pour la conservation de l’espèce. LECA, 15p.
DIERKS K., 2006. Beobachtungen zur Larvalbiologie von Coenonympha oedippus (Fabricius, 1787) im Südwesten Frankreichs (Lepidoptera, Satyridae). Entomologische Zeitschrift 116 (4): 186-188.
DROUET E., 1989. La situation de Coenonympha oedippus Fabricius dans le département de l’Isère (Lepidoptera Nymphalidae Satyrinae). Bulletin mensuel de la Société Linnéenne de Lyon 58 (10) : 345-349. LIEN
Dupéré R., 2015. Sites des tourbières de l’Estanque et de l’Estiraux (40-Mées), Rapport d’activité 2014, 3ème année du plan de gestion, Conservatoire d’espaces naturels d’Aquitaine, 63 pages + annexes.
DUPERE R., ROBINET C, 2015. Sites des tourbières de l’Estanque et de l’Estiraux (40-Mées). Rapport d’activité 2015, 4ème année du plan de gestion. Conservatoire des espaces naturels d’Aquitaine. 20 p. + Annexes.
DUSEJ G., WERMEILLE E., CARRON G. & ZIEGLER H., 2010. Concerning the situation of the False Ringlet Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) in Switzerland. Oedippus 26 : 38-40. LIEN
Ehrlich P. R., 1989. The structure and dynamics of butterfly populations. In Vane-Wright RI, Ackery PR (eds) The Biology of Butterflies. Princeton University Press, Princeton, pp.25-40. LIEN
ETEN Environnement, 2017. Réponse à l’avis de l’autorité environnementale du 22 Août 2017 dans le cadre du projet photovoltaïque de Garein. ETEN Environnement. 13p.
FAILLIE L., 1967. Coenonympha oedippus dans la Sarthe et le Maine-et-Loire. Alexanor 5 (2) : 54-55 pp.
FERNÁNDEZ RUBIO, F. 1991. Guía de las mariposas diurnas de la Península Ibérica, Baleares, Canarias, Azores y Madeira, Pirámide, Madrid.
GALANTE, E. 2012. Coenonympha oedippus. En: VV.AA., Bases ecológicas preliminares para la conservación de las especies de interés comunitario en España: Invertebrados. Ministerio de Agricultura, Alimentación y Medio Ambiente. Madrid. 16 pp.
GOURVIL P.-Y. & SOULET D., 2016. Synthèse et analyse de l’étude génétique réalisé dans le cadre du programme « Papillons menacés des zones humides en Aquitaine ». CEN Aquitaine, 56p.
GOURVIL P.-Y., SOULET D., COUANON V., SANNIER M., DROUET E., SIMPSON D. & VAN HALDER I., 2016. Pré-Atlas des rhopalocères et zygènes d’Aquitaine. Synthèse des connaissances 1995-2015. CEN Aquitaine, LPO Aquitaine, Novembre 2016. 217p. LIEN
GRADL F., 1945. Coenonympha oedippus F. Bericht über die Aufzucht dieser Art aus Freilandraupen und aus Eiern. Einiges über die ersten Stände. Zeitschrift der Wiener Entomologischen Gesellschaft 30: 14-20. LIEN
COLLECTIF, 2010. Expertise « Avenir du Massif Landais ». Groupe de travail n°4: Territoires, eau, biodiversité.
HABELER H., 1972. Zur Kenntnis der Lebensräume von Coenonympha oedippus F. Nachrichtenblatt der Bayerischen Entomologen 21 : 51-55. LIEN
Haddad N.M., Hudgens B., Damiani C., Gross K., Kuefler D. & Pollock K., 2008. Determining optimal population monitoring for rare butterflies. Conservation Biology, 22(4) : 929–940. LIEN
Hafner J., 1910. Makrolepidopteren von Görz und Umgebung. Entomologischen Zeitschrift, Sonder-Abdruck, pp 1–40. LIEN
HENNIAUX C., 2016. Génétique et morphométrie des populations européennes de Coenonympha oedippus. Master 2 BGE / EPHE, LECA, 34p. + annexes.
KODANDARAMAIAH U. & WAHLBERG N., 2009. Phylogeny and biogeography oh Coenonympha butterflies (Nymphalidae : Satyrinae) – patterns of colonization in the Holartic. Systematic Entomology, 34 : 315-323. LIEN
Kolar H., 1919. Über das Vorkommen von Coenonympha oedippus F. Z Österr Entomol Ver Wien 4:96. LIEN
KOLAR H., 1922. Coenonympha oedipus F. v. monticola Kolar (n. subsp.). Verhandlungen der oologischbotanischen Gesellschaft in Wien 71: Sitzungsberichte p. 12-13. LIEN
KOLAR H., 1929. Verbreitung von Coenonympha oedippus F. in Europa. Verhandlungen der zoologischbotanischen Gesellschaft in Wien 78 (1928): Sitzungsberichte pp. 105-108. LIEN
Kudrna O., 1986. Aspects of the conservation of butterflies in Europe. AULA Verlag, Wiesbaden: 343pp. LIEN
Kudrna O., 2002. The Distribution Atlas of European Butterflies. Oedippus 20: 1-343. LIEN
Kudrna O., Harpke A., Lux K., Pennerstorfer J., Schweiger O., Settele J., Wiemers M., 2011. Distribution Atlas of Butterflies in Europe. Gesellschaft für Schmetterlingsschutz e.V, Halle. LIEN
Kudrna O., Pennerstorfer J. & Lux K., 2015. Distribution Atlas of European butterflies and skippers. – Wissenschaftlicher Verlag Peks i.K., Schwanfeld, Germany LIEN
LABOUREL V., 2015. Site des Tourbières de Vendoire, Rapport d’activité 2015, Plan quinquennal 2014-2018, 2ème année, Conservatoire d’espaces naturels d’Aquitaine, 87 pages + annexes.
LAGARDE M., 1997. Etude d’un papillon menacé, le Coenonympha oedippus, sur la réserve naturelle de l’Etang de Cousseau (Gironde). Rapport de B.T.S., 35p. + annexes.
LAFRANCHIS J., 2004. Le Fadet des Laîches. Insectes n°133 : p.21-22. LIEN
LAFRANCHIS T., JUTZELER D., GUILLOSSON J-L., KAN P.&B., 2015. La vie des papillons. Ecologie, Biologie et Comportement des rhopalocères de France. Diatheo. 754 p. LIEN
Leenknegt V., 2017. Suivi écologique 2013-2022, Coenonympha oedippus, Orthez. CATZH 64-CEN Aquitaine, 2p.
LHONORÉ J., 1998. Biologie, écologie et répartition de quatre espèces de Lépidoptères Rhopalocères protégés (Lycaenidae, Satyridae) dans l’ouest de la France. Rapports d’études de l’OPIE vol. 2. OPIE, Guyancourt, 78 p. LIEN
LHONORÉ, J., & LAGARDE, M., 1999 – Biogéographie, écologie et protection de Coenonympha oedippus (Fab., 1787) (Lepidoptera : Nymphalidae : Satyrinae). Annales de la Société Entomologique de France (N.S.) 35 (suppl.) : 299-307.
Loydi A., Eckstein R.L., Otte A. & Donath T., 2013. Effects of litter on seedling establishment in natural and semi-natural grasslands: a meta-analysis. Journal of Ecology 101 : 454–464. LIEN
Möllenbeck V, Hermann G, Fartmann T., 2009. Does prescribed burning mean a threat to the rare satyrine butterfly Hipparchia fagi ? Larval-habitat preferences give the answer. Journal of Insects Conservation 13:77–87. LIEN
NEVE G., DUBUT V., SCHMITT T & GILLES A., 2014. Différenciation entre populations de Coenonympha oedippus (Lepidoptera, Nymphalidae) en France. 19p. + annexes.
ÖRVÖSSY N., VOZÁR A., KŐRÖSI A., BATÁRY P., & PEREGOVITS L., 2010. Structure and size of a threatened population of the False Ringlet Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) in Hungary. Oedippus 26 : 31-37. LIEN
ÖRVÖSSY N., KÖRÖSSI A., BATARY P., VOZAR A. & PEREGOVITS L., 2013. Potential metapopulation structure and the effects of habitat quality on population size of the endangered False Ringlet butterfly. Journal of Insects Conservation, 17 : 537-547. LIEN
PARDE J.-M., 2014. Etude du comportement de ponte et de la reproduction du Fadet des Laîches (Coenonympha oedippus) sur la tourbière de Lourdes. 14p. AREMIP. LIEN
PELLET J. & GANDER A, 2009. Comparaison de méthodes pour l’estimation de l’abondance des populations de papillons de jour: établissement d’un protocole de suivi du Grand Nègre des bois (Minois dryas (Scopoli, 1763)) sur la rive sud du lac de Neuchâtel. Entomo Helvetica, Vol.2, pp.101-116. LIEN
PELLET J., BRIED J. T., PARIETTI D., GANDER A., HEER P. O., CHERIX D. & ARLETTAZ R., 2012. Monitoring Butterfly Abundance : Beyond Pollard Walks. PLoS ONE, vol.7, n°7. LIEN
Planungsbüro für angewandten Naturschutz (PAN) GmbH, 2006a. Übersicht zur Abschätzung von maximalen Entfernungen zwischen Biotopen für Tierpopulationen in Bayern Stand. 7p. LIEN
Planungsbüro für angewandten Naturschutz (PAN) GmbH, 2006b. Übersicht zur Abschätzung von Minimalarealen von Tierpopulationen in Bayern Stand. 12p. LIEN
Polic D., Fiedler K., Nell C & Grill A., 2014. Mobility of ringlet butterflies in high-elevation alpine grassland: effects of habitat barriers, resources and age. Journal of Insect Conservation, 18 : pp. 1153–1161. LIEN
POLLARD E., 1982. Monitoring butterfly abundance in relation to the management of a nature reserve. Biological Conservation, 24 : 317-328. LIEN
Pollard E. & Yates T. J., 1993. Monitoring Butterflies for Ecology and Conservation. Chapman & Hall, London, 275p. LIEN
PRO NATURA – Ligue suisse pour la protection de la nature, 1987. Les papillons et leurs biotopes. Espèces-Dangers qui les menacent-Protection. Suisse et régions limitrophes. Tome 1. Fotorotar SA, CH-8132 Egg.PUISSAUVE R. & LEGROS B., 2015. Fiche espèce Fadet des Laîches, Oedipe (Coenonympha oedippus, FABRICIUS, 1787). ONEMA, 4p. LIEN
PUISSAUVE R. & LEGROS B., 2015. Fiche espèce Fadet des Laïches, Oedipe (Coenonympha oedippus, FABRICIUS, 1787). ONEMA, 4p. LIEN
ROBINET, C. & F. BECK, 2017. Sites des tourbières de l’Estanque et de l’Estiraux (40-Mées). Rapport d’activité 2016, 5ème année du plan de gestion. Conservatoire des espaces naturels d’Aquitaine. 17 p. + 7 Annexes : p9.
ROQUES O., 2014. Etude pour la définition de mesures de gestion favorables au Fadet des Laîches Coenonympha oedippus (FABRICIUS, 1787) dans les landes de Montendre. 52p. + annexe.
Ruehl F., 1895. Die paläarktischen Großschmetterlinge und ihre Naturgeschichte. Lief. 55, Leipzig.
Ruprecht E. & Szabo A., 2012. Grass litter is a natural seed trap in longterm undisturbed grassland. Journal of Vegetation Science 23:495–504. LIEN
SASIC M., 2010. False Ringlet Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) in Croatia : current status, population dynamics and conservation management. Oedippus 26 : 16-19. LIEN
Seitz A., 1906. The Macrolepidoptera of the Palearctic Region 1. Stuttgart, 379p. LIEN
SELEZNIEW M., PAŁKA K., MICHALCZUK W., BYSTROWSKI C., HOŁOWIŃSKI M., & CZERWIŃSKI M., 2010. False Ringlet Coenonympha oedippus (FABRICIUS, 1787) (Lepidoptera: Nymphalidae) in Poland : state of knowledge and conservation prospects. Oedippus 26 : 20-24. LIEN
Settele J., Kudrna O., Hharpke A., KÜhn I., van Swaay C., Verovnik R., Warren M., Wiemers M., Hanspach J., Hickler T., KÜhn E., van Halder I., Veling K., Vliegenthart A., Wynhoff I. & Schweiger O., 2008. Climatic risk atlas of European butterflies. Pensoft, Sofia-Moscow. LIEN
SOULET D., 2013. Participation du CEN Aquitaine à la mise en place d’un Plan de Gestion sur la lande du Camp de Ger (64) – Compte-rendu des années 2012 et 2013. 9 p.
Stacey P.B., Johnson V.A. & Taper L.M., 1997. Migration within metapopulations: The Impact upon Local Population Dynamics. V: Metapopulation biology. Ecology, Genetics and Evolution. Hanski I. & Gilpin M.E. (ur.). San Diego, Academic Press: 267–291. LIEN
Taron D. & Ries L., 2015. Butterfly Monitoring for Conservation. In : Daniels J. (eds) Butterfly Conservation in North America. Springer, Dordrecht, pp. 35-57. LIEN
Tolman T. & Lewington R., 2008. Collins Butterfly Guide. Harper Collins Publishers, London, 384p. LIEN
Van Halder I., 2017. Conservation of butterfly communities in mosaic forest landscapes : effects of habitat quality, diversity and fragmentation. Ecosystems. Thèse, Université de Bordeaux. 206p. + annexes. LIEN
Van Helsdingen P.-J., Willemse L., Speight M. C. D., 1996. Background information on invertebrates on the Habitats Directive and the Bern Convention, Council of Europe, 217p.
Van Swaay C.A.M. & Warren, M.S., 1999. Red Data book of European butterflies (Rhopalocera). Nature and Environment, No. 99, Council of Europe Publishing, Strasbourg. LIEN
Van Swaay C., Cuttelod A., Collins S., Maes D., López Munguira M., Šašić M., Settele J., Verovnik R., Verstrael T., Warren M., Wiemers M. and Wynhof I., 2010. European Red List of Butterfies. Luxembourg: Publications Office of the European Union. LIEN
VARIN G., 1964. Contribution à l’étude des satyridae (Lépidoptères) Coenonympha oedippus Fabricius, Sous-espèce Rhodanica Varin nova en Savoie. In: Bulletin mensuel de la Société linnéenne de Lyon, 33ᵉ année, n°3, mars 1964. pp. 92-93. LIEN
VIEJO, J. L., MARTÍN, J., GARCÍA-BARROS, E. & MUNGUIRA, M. L. 1989. The status of the Iberian Lepidoptera listed in the appendices of Bern Convention. Colloquium: The Bern Convention of Invertebrates and their conservation: 42-44. Council of Europe. LIEN
VIEJO, J. L., MARTÍN, J., GARCÍA-BARROS, E. & MUNGUIRA, M. L. 1991. The Bern Convention and the Spanish Lepidoptera. In Collins, N. M. and Thomas, J. A. (eds.). The conservations of insects and their habitats: 428-429. Academic Press, London.
VIVES, A. 1994. Catálogo sistemático y sinonímico de los lepidópteros de la península Ibérica y Baleares (Insecta, Lepidoptera) (Segunda Parte). Ministerio de Agricultura, Pesca y Alimentación, Madrid. LIEN
Vozár A., Örvössy N., Kocsis M., Kőrösi A. & Peregovits L., 2005. First results of a study on Coenonympha oedippus in Hungary. LIEN
Weking S, Hermann G, Fartmann T., 2013. Effects of mire type, land use and climate on a strongly declining wetland butterfly. Journal of Insects Conservation 17:1081–1091. LIEN
Wiklund C., 1984. Egg-laying patterns in butterflies in relation to their phenology and the visual apparency and abundance of their host plants. Oecologia (Berlin) (1984) 63 : 23-29. LIEN
WIEMERS M., 2007. Die Gattung Coenonympha HÜBNER, 1819, in Europa: Systematik, Ökologie und Schutz (Lepidoptera: Papilionoidea: Nymphalidae: Satyrinae). Oedippus 25 : 1-42. LIEN